L'ARTROSI o osteoartrosi, è un processo patologico che trae origine dalla perdita del fisiologico equilibrio tra processi degradativi e
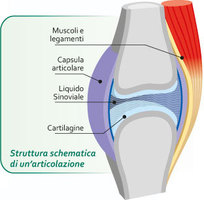
processi riparativi a carico della cartilagine articolare. E’ una malattia che interessa principalmente le articolazioni sinoviali o diartrodiali costituite dai capi ossei articolari contrapposti
rivestiti da cartilagine articolare e contenuti dalla capsula articolare e dei legamenti. La cartilagine articolare, o cartilagine di incrostazione, è un tessuto peculiare altamente
differenziato dotato di particolari proprietà visco elastiche che si adatta allo scivolamento reciproco dei capi ossei. Questo tipo di cartilagine è detto jalino per il suo aspetto liscio e
traslucido. Una membrana connettivale collega i capi ossei articolari. La parte esterna, capsula articolare, è costituita da tessuto fibroso, molto resistente ma poco elastico che si inserisce sullo
strato più esterno dell’osso (periostio) mentre la parte interna (sinoviale o membrana sinoviale) so inserisce ai margini delle cartilagini articolari e delimita la cavità articolare. In essa si
trova in condizioni normali una scarsa quantità di liquido sinoviale che ha importati funzioni di lubrificazione e di nutrimento per la cartilagine stessa. La capsula articolare e le strutture
limitrofe fibrolegamentose sono molto ricche di terminazioni nervose e, unitamente alle estremità ossee, sono la sedi dalle quali originano maggiormente gli stimoli dolorosi in caso di danno
localizzato. La membrana sinoviale è particolarmente ricca di vasi sanguigni e linfatici e quindi è il primo luogo ove si può formare un processo infiammatorio. In alcune articolazioni (temporo
mandibolari, sternoclaveare, ginocchio) è presente una fibrocartilagine, detta menisco, che migliora il reciproco adattamento dei capi articolari.
Manifestazioni di tipo degenerativo sotto forma di rammollimento, discontinuità ed erosioni della cartilagine sono di comune riscontro in particolare nella età adulta ed avanzata, tuttavia si può
parlare di malattia artrosica quando il processo patologico investe tutte le strutture costituenti la articolazione e cioè il coinvolgimento riguarda anche le modificazioni dell’osso delle
strutture fibrose e legamentose vicine e quindi un fenomeno regressivo che turba la normale fisiologia della unità funzionale articolare.
QUANTO E’ DIFFUSA QUESTA MALATTIA?
L’artrosi è una affezione che colpisce praticamente tutti i vertebrati e, nella specie umana, è forse la affezione più diffusa in
particolare nella popolazione di età media e senile. Segni radiologici di artrosi si possono riscontrare in oltre l’80% delle persone oltre i 50 anni e di questi circa ¼ ne soffre in modo pressoché
costante. In Italia colpisce circa 4 milioni di persone e rappresenta uno dei più frequenti motivi di ricorso a visita medica negli ambulatori del medico di medicina generale. Gli studi
epidemiologici che si basano sulla diagnosi radiologica indicano una prevalenza di malattia pari a circa il 50% della popolazione compresa tra i 15 e 79 anni. L’artrosi colpisce più frequentemente le
donne e tale maggior frequenza è più evidente dopo i 55 anni quando l’incidenza è più alta mentre prima dei 45anni il maschio risulta più affetto. La precocità di insorgenza del quadro clinico
dell’artrosi negli uomini può essere ricondotta all’attività lavorativa. I tassi di prevalenza ed incidenza variano secondo le casistiche non essendo univoci i criteri classificativi. Le differenze
riguardano in particolare l’inclusione di forme esclusivamente secondo un criterio radiografico ovvero considerando l’espressione clinica o entrambi. Criteri classificativi validati esistono inoltre
solo per la forma che interessa le articolazione di ginocchio, anca, mano.
Numerosi contributi hanno documentato come sovente non esista una correlazione fra quadro clinico radiologico ed entità del dato clinico. Genericamente si può affermare che solamente il 30% circa di
tutti i soggetti con alterazioni radiologiche di tipo artrosico accusi una significativa sintomatologia dolorosa.
Le sedi più frequentemente colpite sono in ordine decrescente: la colonna lombare (33%), la colonna cervicale (30%), le ginocchia (27%), le anche (25%) la colona in toto (24%), più articolazioni
concomitante (13.9%), le mani (11%) i piedi (9%). Le altre sedi rappresentano circa il 10 %. Si parla di osteoartrosi generalizzata quando oltre all’interessamento delle mani è coinvolto almeno un
altro distretto articolare (anca, ginocchio). Con il passare degli anni diventa più frequente l’interessamento poliarticolare. Complessivamente si può affermare che in generale la forma sintomatica
interessa il 9.6% degli uomini ed il 18% delle donne oltre i 60 anni). In Italia la prevalenza dell’artrosi sintomatica è stata indagata in soggetti ultra65enni residenti a Dicomano (Firenze) in uno
studio del 2003: per l’anca è risultata del 7.5% (717.000 pazienti in proiezione nazionale), per il ginocchio 29.9% (2.858.440 in proiezione nazionale). Altri studi di popolazione hanno documentato
una incidenza di circa 1%/anno di artrosi del ginocchio (gonartrosi) sintomatica in anziani oltre i 70 anni. A seconda della popolazione studiata e dei rilievi epidemiologici usati la
prevalenza della gonartrosi documentata radiologicamente, con o senza sintomi, varia da 3.8% (età tra 25 e 74 anni) a 14 e 30% (oltre i 45 anni). Tra i 75 e 79 anni raggiunge percentuali del 40-60%.
In uno studio nord europeo la prevalenza della artrosi dell’anca (coxartrosi), secondo i criteri radiologici, oltre i 60 anni è risultata del 3.7% in uomini e 5.6% nelle donne con un interessamento
bilaterale nel 44% dei casi. In uno studio di popolazione del Veneto (studio PROVA, progetto Veneto Anziani 2003) la prevalenza della artrosi sintomatica in 1854 donne e 1245 uomini con età maggiore
di 65 anni è risultata del 26% per le femmine e del 12% per i maschi per la forma al ginocchio e, rispettivamente, del 14% e dell’8% per l’interessamento dell’anca.
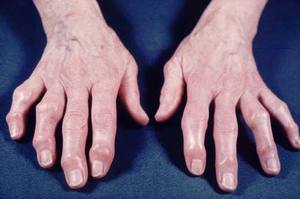
L’osteoartrosi primaria delle mani è più frequente nelle donne intorno alla 4° e 5° decade di vita. Se si considera solo il criterio radiologico la prevalenza nell’età senile sale al 90% per le donne
e 80% per gli uomini. Per ciò che concerne l’osteoartrosi delle mani sintomatica studi recenti condotti in Italia hanno dimostrato una prevalenza variabile dal 15% (dall’età di 65 anni) al 30%
(dall’età di 40 anni). In circa 1 caso su 10 la malattia alle mani presenta aspetti più gravi con danno osteoarticolare erosivo che può determinare persistente limitazione funzionale.
L’interessamento artrosico della colonna è precoce e frequente. Prima dei 50 anni risulta interessato più spesso il tratto cervicale nelle donne e quello lombare negli uomini. In un terzo dei casi la
sede più frequente di artrosi sintomatica è il tratto rachideo lombare o cervicale. I segni radiologici di malattia si riscontrano sempre più frequentemente con il progredire degli anni fino ad
essere individuati nel 70-80% dei soggetti alla sesta decade di vita. È tuttavia difficile esprimere dati riguardanti le manifestazioni cliniche perché proprio nella localizzazione rachidea è più
alta al discrepanza tra sintomi ed aspetti morfologici. Le forme dolorose riferite alla colonna vertebrale possono riconoscere infatti svariate cause.
Il dolore cervicale si riscontra frequentemente nella pratica clinica. L’incidenza della cervicoalgia, con o senza irradiazione al braccio, è di circa 13% nelle donne e 9% negli uomini nella
popolazione generale con una prevalenza media del 18% . Una persona su tre può ricordare un episodio di dolore al collo almeno una volta nella sua vita. Indubbiamente fattori inerenti l’attività
lavorativa o post traumatici sono determinanti per l’insorgenza e mantenimento dei sintomi.
Almeno 2/3 delle persone adulte conosce il dolore lombare (low back pain) e ciò rappresenta una delle più frequenti cause in assoluto di consultazione medica. Viene riferito almeno un episodio di
lombalgia negli ultimi 12 mesi da un numero di persone corrispondente al 10-30% del campione esaminato a seconda delle ricerche effettuate e si arriva ad oltre il 60% in addetti a lavorazioni
industriali di sesso maschile tra i 40 e 47 anni di età. Il carattere sociale di questa patologia è determinato dal costo rilevante espresso sia in giornate lavorative perse che in assistenza diretta
fornita. I meccanismi patogenetici precisi rimangono sconosciuti nella maggioranza dei casi anche se riguardano generalmente aspetti meccanici di “overuse” (sovraccarico, sforzo ripetuto) o
deformazione di strutture anatomiche. Nel 10% dei casi la lombalgia è espressione di una affezione sistemica e tende a mantenersi nel tempo. In generale la prognosi è buona: più del 90% dei soggetti
migliora in otto settimane ma la recidiva è comune e interessa il 40% dei pazienti entro 6 mesi .
PERCHE’ CI SI AMMALA DI ARTROSI?
L’artrosi è il risultato finale non specifico di processi patologici diversi, i quali, in ultima analisi, determinano uno scompenso
articolare che deriva da una discrepanza tra quantità di lavoro richiesto alla articolazione e capacità di lavoro sostenibile dalla stessa. Lo scompenso può essere determinato o perché il carico è
eccessivo o perché la resistenza articolare è ridotta. In questo gioco è importante il ruolo svolto dalle modalità secondo cui il carico si distribuisce sulle superfici articolari: ogni
inappropriato aumento della pressione di contatto tra le superfici contrapposte favorisce l’insorgenza di artrosi.
Sebbene varie condizioni patologiche, genetiche-costituzionali, ambientali e lavorative siano determinanti per lo sviluppo della malattia, l’età risulta essere il fattore di rischio principale. È
noto infatti come l’artrosi vada progressivamente aumentando di frequenza con l’età anche se il vero meccanismo per il quale tale correlazione si verifichi è a tutt’oggi poco conosciuto. I
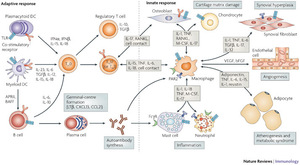
rilievi immuno istochimici consentono una distinzione tra artrosi senile ed invecchiamento fisiologico della cartilagine articolare. Il ruolo principale nella degradazione della cartilagine è
sostenuto, almeno nelle fasi iniziali, dalla cellula principale del tessuto cartilagineo: il condrocita. In esso si viene a creare uno squilibrio tra attività costruttiva (anabolica) e distruttiva
(catabolica) con prevalenza di quest’ultima e quindi depauperamento delle sostanze costitutive della cartilagine (proteoglicani), riduzione delle proprietà fisico chimiche per diminuzione del
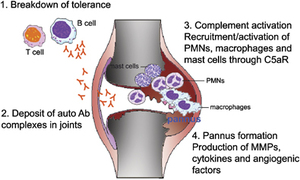
contenuto in acqua, indebolimento della struttura di sostegno fibrillare. Piccoli frammenti di cartilagine vengono fagocitati dalle cellule della membrana sinoviale dove si manifesta una conseguente
reazione infiammatoria. A questa reazione può contribuire anche la liberazione di microcristalli di idrossiapatite (sali di calcio e fosfato costituenti il tessuto osseo) nonchè lo smascheramento di
neo-antigeni cartilaginei. La risposta infiammatoria si traduce nella liberazione di numerosi mediatori biologicamente attivi. Tra questi svolgono un ruolo centrale alcune citochine, le
prostaglandine e le chinine più direttamente responsabili della comparsa di manifestazione cliniche come dolore, tumefazione che caratterizzano il decorso della malattia. Le alterazioni biochimiche
della cartilagine articolare, qualunque siano le loro cause e modalità di insorgenza, comportano una modifica delle sue proprietà meccaniche: in particolare viene a diminuire l’azione ammortizzatrice
(shock absorbtion) delle sollecitazioni meccaniche cui è sottoposto l’osso sottostante (osso subcondrale). Nelle aree sottoposte a carico questo comporta una reazione dell’osso che diventa più
compatto nel tentativo di aumentare la sua resistenza ma ciò a scapito della sua elasticità. La cartilagine sovrastante viene pertanto a trovarsi tra “l’incudine” (l’osso subcondrale) ed il
“martello” (le sollecitazioni meccaniche) è ciò comporta una accelerazione ed estensione del danno fino alla possibile scomparsa del tessuto cartilagineo. L’osso sottostante si addensa ma risulta più
fragile e compensa talvolta cercando di estendere la superficie di carico producendo i cosiddetti “osteofiti” a margine della articolazione. Anche la cartilagine residua presenta tentativi di
riparazione producendo noduli cartilaginei in aree limitiate che alterano il profilo articolare e risultano funzionalmente inefficaci.
QUALI SONO I FATTORI RESPONSABILI DELL’INSORGENZA O AGGRAVAMENTO DEL DANNO ARTROSICO?
Vari sono i fattori che influenzano l’insorgenza e l’andamento della malattia. Possiamo distinguerli in fattori sistemici e fattori
locali: alcuni sono modificabili altri no.
Tra i fattori sistemici di seguito verranno discussi i principali:
1. Età. Sebbene l’incidenza delle manifestazioni artrosiche aumenti in relazione all’età, l’invecchiamento, di per
sé, non è causa di artrosi: infatti i costituenti e le proprietà biologiche della cartilagine articolare non si modificano sostanzialmente con l’età. Nel tempo tuttavia si assommano insulti meccanici
ed eventuali cause biochimiche che rendono la cartilagine sempre più vulnerabile.
2. Fattori genetici: sono fattori che condizionano al diversa espressione di malattia. Ad esempio l’artrosi delle mani è frequente nella razza bianca mentre la gonartrosi risulta rara nelle
donne orientali. Per l’artrosi delle articolazioni interfalangee distali è stata prospettata la dipendenza da un singolo gene che si comporta come dominante nel sesso femminile e recessivo nel sesso
maschile. Per altre forme di artrosi periferica e della colonna vertebrale l’ereditarietà sarebbe di tipo poligenico e recessivo. Sono geneticamente dipendenti inoltre altre condizioni
quali la lussazione congenita di anca o la ocronosi (vedi in seguito) che favoriscono l’insorgenza di artrosi secondaria
3.Sesso e fattori ormonali. E’ noto che la donna abbia in genere una maggior espressione di malattia in termini di numero di articolazioni interessate e gravità. Non è tuttavia ancora chiarita la
differenza attribuibile all’influenza dei cromosomi sessuali o quanto invece dipenda dal diverso assetto ormonale. In particolare non è ancora definito il ruolo protettivo degli estrogeni sulla
cartilagine. Anche se il climaterio è il periodo in cui frequentemente la malattia compare o si intensifica è verosimile l’ipotesi che la menopausa coincida con un periodo di maggior vulnerabilità e
soprattutto di ridotta soglia alla stimolazione dolorifica.
4. Obesità e disturbi circolatori: l’obesità agisce negativamente sulle articolazioni a causa del sovraccarico funzionale che impone sulle articolazioni portanti. La relazione è
particolarmente evidente per le ginocchia e per la colonna lombare. L’obesità, inoltre, è spesso associata ad altre condizioni (diabete, dislipidemia) che potrebbero favorire di per sé lo sviluppo di
processi degenerativi articolari. L’artrosi delle ginocchia e delle estremità inferiori è favorita inoltre da alterazioni del circolo venoso refluo, verosimilmente per il disturbo trofico che
coinvolge tutti i tessuti degli arti inferiori.
5. Fattori metabolici. Alcune malattie endocrine come l’acromegalia, l’ipotirodismo possono determinare una modifica della struttura cartilaginea favorendone la degenerazione. Anche il
diabete e l’iperlipidemia possono interferite con il metabolismo del tessuto cartilagineo e favorire l’insorgenza di manifestazioni artrosiche. Una rara malattia denominata ocronosi ereditaria
e dovuta ad una carenza enzimatica (deficit acido omogentesinico ossidasi) causa la deposizione di un pigmento nella cartilagine articolare e nei dischi intervertebrali e determina una grave forma
artrosica. Anche al gotta e la condrocalcinosi che causano la deposizione all’interno della cartilagine di microcristalli, rispettivamente di urato monosodico e di pirofosfato di calcio e
contribuiscono a favorire i processi degenerativi articolari (artrosi uratica, artrosi condrocalcinosica) ai quali si associano le reazioni infiammatorie proprie delle artropatia cristalline.
6. Clima. Contrariamente all’opinione corrente i fattori climatici non sono in grado di determinare alterazioni di natura artrosica. Il freddo e l’umidità tuttavia favoriscono l’espressione
clinica dei sintomi, mentre i climi caldi e secchi hanno influenza benefica su di essi.
Oltre ai fattori sistemici possiamo ricordare che esistono delle condizioni locali che possono favorire o aggravare la malattia. Se da un lato una attività moderata e
continuativa è utile a mantenere il trofismo e la lubrificazione articolare (la cartilagine articolare tende ad atrofizzarsi negli arti immobilizzati a lungo), il sovraccarico funzionale, anche
di articolazioni originariamente indenni e di normale conformazione, può indurre l’insorgenza di un processo artrosico. Sono noti numerosi quadri artrosici legati a particolari attività
professionali o sportive: artrosi dei gomiti nei soggetti utilizzanti strumenti vibranti, artrosi del ginocchio o caviglia in calciatori etc..) Anche in assenza di un eccesso di lavoro meccanico, il
processo artrosico può essere favorito da alterazioni della architettura articolare per malformazioni di natura congenita (displasie) o modifiche strutturali acquisite, per esempio in seguito ad una
frattura o ad un processo infiammatorio protratto ed importante.. Tali alterazioni determinano una ineguale distribuzione del carico sulle superfici articolari con sovraccarico di limitate aree che
andranno incontro precocemente ad usura. In altri casi l’architettura della articolazione è normale, tuttavia esistono condizioni responsabili di alterazione della dinamica articolare. Ne sono esempi
la sublussazione recidivante della rotula e l’instabilità articolare da lassità legamentosa. In queste condizioni si viene a creare un sovraccarico di limitate aree di cartilagine articolare o di
aree che normalmente non sono sottoposte al carico con compromissione della normale struttura articolare.
COME SI MANIFESTA LA MALATTIA ARTROSICA E COME POSSIAMO DIAGNOSTICARLA?
Indipendentemente dalla localizzazione, la malattia artrosica si presenta con manifestazioni cliniche relativamente costanti. I
sintomi sono essenzialmente rappresentati dal dolore e dalla rigidità articolare dopo immobilizzazione. Obiettivamente l’artrosi si manifesta con limitazione dei movimenti articolari, deformazione
articolare ed eventualmente altri segni come scrosci e crepitii udibili alla mobilizzazione dell’articolazione.
Nelle fasi iniziali il dolore è in genere di lieve entità ed incostante in quanto si comporta come dolore di tipo meccanico cioè chiaramente in rapporto con l’utilizzo della articolazione
interessata. Inizialmente il dolore può insorgere soltanto in occasione di sforzi intensi e/o prolungati. Con il tempo diventa sempre meno importante il carico imposto necessario a risvegliare la
sintomatologia dolorosa e, nelle fasi avanzate, il dolore può diventare subcontinuo o continuo e persistere anche nelle ore di riposo o alla notte. È importante ricordare che i fenomeni dolorosi
nell’artrosi sono spesso conseguenti a contratture muscolari riflesse oppure a compressioni di radici nervose che risultano coinvolte per contiguità rispetto alla articolazione interessata. In
generale il sintomo dolore è, come in molte malattie reumatiche, fortemente influenzato da altri fattori di ordine affettivo psicologico oltre che da altre situazioni di tipo climatico
ambientale.
Dopo il riposo notturno o dopo immobilizzazione per un determinato periodo di tempo l’articolazione interessata dimostra una certa incapacità a riprendere la consueta mobilità. Questa rigidità si
risolve in genere dopo pochi minuti di esercizio, dopo cioè che l’articolazione si sia “scaldata”. Nella artrosi questa rigidità è in genere di durata inferiore rispetto alla malattia reumatiche a
spiccata impronta infiammatoria come l’artrite reumatoide.
Il processo artrosico può conferire alla articolazione interessata un aspetto grossolano prevalentemente in conseguenza a processi estruenti dei capi ossei. La reazione ossea può produrre degli
appuntimenti duri (osteofiti) apprezzabili nelle articolazioni più superficiali come nodosità. All’aspetto grossolano dei capi scheletrici possono aggiungersi disassamenti dei segmenti scheletrici.
In genere la deformazione e la perdita di congruenza dei capi ossei determina una riduzione della escursione articolare. Tale limitazione è inizialmente in rapporto ad un meccanismo antalgico
di contrattura muscolare e solo nelle fasi avanzate è legata alla deformazione ossea. Tipicamente la limitazione inizialmente colpisce pochi movimenti, per esempio nella artrosi dell’anca
l’estensione e la rotazione del femore, ma poi con la progressione della malattia il quadro evolve e si può giungere al blocco completo (anchilosi)
La diagnosi della malattia è essenzialmente clinica basata cioè sulla visita della persona con la raccolta delle caratteristiche dei sintomi e con il dato obiettivo. Spesso il quadro è
suffragato da dati di laboratorio e radiologici. Si può classificare l’artrosi in relazione alla possibile causa prevalente. Si distinguono così tre gruppi fondamentali: l’artrosi primaria, la
artrosi dismetabolica e l’artrosi secondaria.
Nella artrosi primaria non è possibile identificare un meccanismo eziopatogenetico specifico. Queste forme sono espressione di un difetto intrinseco della cartilagine articolare. Questo difetto
costituzionale è geneticamente condizionato. Un esempio è dato dalla artrosi nodulare delle mani che interessa prevalentemente le donne all’età della menopausa. Spesso si riconosce in questo caso una
aggregazione familiare. Nell’ambito delle artrosi primarie si distinguono inoltre, in rapporto alla localizzazione, le forme generalizzate e quelle localizzate.
Nelle forme dismetaboliche il difetto che determina la degenerazione della cartilagine articolare è noto. Rientrano in questa categoria le artrosi conseguenti all’accumulo di microcristalli di acido
urico o di pirofosfato di calcio. Anche il diabete e l’acromegalia possono condizionare la integrità della cartilagine articolare e quindi favorire lo sviluppo di una forma artrosica.
Nelle artrosi secondarie è chiaro il rapporto di dipendenza con condizioni o stati morbosi che hanno favorito la degenerazione articolare. In questo gruppo si riconoscono forme secondarie a
sovraccarico articolare dovute a displasie articolari, sublussazioni, instabilità articolare, iperattività professionale o sportiva. Esistono forme secondarie a traumi, fratture, lussazioni
recidivanti. La malattia artrosica inoltre può essere conseguente a danni articolari indotti da processi infiammatori (artriti) o malattie dei capi ossei (ostoenecrosi, osteocondrite).
La conferma diagnostica della malattia poggia sulla indagine radiologica tradizionale che rivela i segni classici dell’affezione rappresentati da riduzione non uniforme della interline articolare,
sclerosi dell’osso subcondrale con possibili aree di riassorbimento (geodi o cavità pesudocistiche), osteofitosi. Esiste una dissociazione clinico radiologica: a minime manifestazioni cliniche
possono far riscontro marcate alterazioni radiografiche, specie a livello della colonna vertebrale. D’altra parte può accadere che sintomi rilevanti si associno a modeste alterazioni radiografiche.
In questo caso è verosimile che l’origine dei sintomi sia attribuibile a sofferenza di strutture non radio-opache come tendini, muscoli, nervi. Altre indagini utilizzate in alcuni casi a scopo
diagnostico sono la tomografia assiale computerizzata (TAC) utile per la valutazione dell’integrità di strutture accessorie, per la diagnosi di protrusioni o erniazioni discali alla colonna.
L’artroscopia è una tecnica invasiva che permette la visione diretta delle alterazioni macroscopiche della cartilagine ne consente una precisa stadiazione. Il suo vantaggio è quello di essere anche
operativa con possibilità di rimozione di corpi mobili , “debridement” articolare ed altro.
I comuni esami di laboratorio sono tipicamente nella norma. La possibile elevazione degli indici di flogosi è aspecifica ed indica l’esistenza di un processo infiammatorio in rapporto ad alcune fasi
di malattia. Al momento non esiste nella pratica clinica la disponibilità di un marker biochimico di malattia dotato di sufficiente sensibilità e specificità per la diagnosi ed il monitoraggio della
malattia.
COME SI CURA L’ARTROSI?
L’artrosi è una malattia curabile e, se la strategia terapeutica viene applicata sulla base di un approccio corretto e
personalizzato, le conseguenze indotte dalla malattia possono essere sensibilmente ridotte. L’obiettivo della terapia è quello di migliorare la qualità di vita del paziente attraverso il controllo
dei dolore, la conservazione della funzionalità articolare e il rallentamento della progressione del danno. Le strategie terapeutiche nell’artrosi possono essere di carattere generale, mediche in
senso generale, non fàrmacologiche o chirurgiche.
I primi passi per una corretta programmazione terapeutica consistono:nell’informare il paziente in modo da far comprendere il fatto che l’artrosi è una vera e propria malattia e non la fatale ed
irreversibile conseguenza dell’invecchiamento. Come in ogni patologia cronica, l’adesione al programma terapeutico è funzione del grado di conoscenza che il paziente ha della malattia e dei
meccanismi che la sostengono. In questo senso una corretta informazione rappresenta il presupposto irrinunciabile di ogni strategia terapeutica E’ importante riconoscere ed, eventualmente, correggere
i fattori di rischio influenzabili quali: il soprappeso, l’uso scorretto di alcune articolazioni, le malattie predisponenti in grado di avere ripercussioni sulla integrità del tessuto cartilagineo.
E’ importante sviluppare dei programmi di economia articolare che mirino a ridurre il sovraccarico articolare. A questo scopo si può anche ricorrere all’impiego di ortesi sotto forma di tutori per le
articolazioni periferiche, corsetti o collari per la colonna vertebrale, plantari od opportune calzature per i piedi.
Nell’ambito delle terapia di tipo fisiatrico la chinesiterapia in scarico rappresenta un punto molto importante in quanto contribuisce a conservare una adeguata mobilità articolare, stimola i
processi riparativi cartilaginei e rinforza la muscolatura connessa all’articolazione contribuendo alla sua stabilità. La massoterapia ha valore come tecnica sintomatica, finalizzata ad interrompere
la contrattura muscolare dolorosa che frequentemente accompagna la localizzazione artrosica. Le cure cosiddette “fisiche” sono tecniche sintomatiche complementari che in generale sfruttano l’azione
del calore. per attenuare la contrattura muscolare e quindi il dolore. Possono essere utilizzate fonti di calore diverse come: le lampade a infrarossi per le forme superficiali, o, per infondere
calore nelle sedi più profonde, onde elettromagnetiche (marconiterapia, radarterapia). In presenza di segni locali di flogosi il calore può aggravare anziché mitigare la sintomatologia dolorosa che
risente favorevolmente dell’applicazione di freddo. Le cure termali consistono in varie tecniche tra cui la balneoterapia (piscina termale), lutoterapia (applicazione di fango termale) e
psammoterapia (“sabbiature”). Esse vengono utilizzate per la cura della artrosi da tempi remoti e contribuiscono ad alleviare il dolore almeno temporaneamente ma è consigliabile inserirle in un
programma terapeutico globale personalizzato.
La terapia farmacologia si basa in primo luogo sull’uso dei farmaci antiinfiammatori non-steroidei (FANS). Oltre ad avere una azione antalgica essi svolgono una attività antiflogistica utile
nelle fasi di riacutizzazioni infiammatoria. Questi farmaci vanno utilizzati con cautela per i possibili effetti secondari, soprattutto a livello del tratto gastroenterico e del rene. Dosi e
tipo di farmaco devono essere adeguati al singolo paziente, spesso di età avanzata e sofferente di patologie concomitanti. Si deve utilizzare un solo FANS per volta. La durata del trattamento è
legata al perdurare della sintomatologia dolorosa fino all’ottenimento del miglioramento clinico-funzionale. Non è stato riconosciuto un FANS più efficace o più indicato rispetto ad altri. La scelta
è dipendente dalla tollerabilità, da alcune caratteristiche legate alla molecola (durata e selettività nella azione) e dalla risposta clinica. Da pochi anni sono disponibili dei farmaci
particolarmente selettivi sulla inibizione delle sostanze ad azione proflogistica, i cosiddetti COXIB. Il vantaggio principale risulta essere una minor incidenza degli eventi collaterali gravi
gastroenterici. D‘altra parte sono emerse delle limitazioni riguardo il possibile ruolo sfavorevole del punto di vista cardiovascolare tanto che per 2 di questi prodotti, rofecoxib e valdecoxib, è
stato deciso il ritiro dal mercato. Anche per i FANS tradizionali tuttavia si stanno definendo i rischi per il sistema cardiocircolatorio. E’ noto infatti che il loro uso può determinare un aumento
della pressione arteriosa e, nei soggetti cardiopatici, un aumento della incidenza di scompenso cardiaco. I prodotti topici (creme , gel) a base di FANS trovano scarsa indicazione nell’artrosi e sono
da riservarsi al trattamento dei reumatismi extra-articolari (dolore muscolare, tendineo).
Qualora il paziente presenti controindicazioni all’impiego di FANS, si può fare ricorso a farmaci ad azione analgesica. Alcuni studi indicano che questi farmaci, se utilizzati a dosi adeguate (fino a
4 grammi di paracetamolo al giorno), sono provvisti di un’efficacia sovrapponibile a quella dei FANS nel trattamento sintomatico dell’artrosi. A questa classe appartengono anche il tramadolo e la
codeina quest’ultima utilizzata in associazione al paracetamolo.
La terapia cosiddetta “di fondo” dell’artrosi si avvale dell’impiego di farmaci che sembrano influenzare il metabolismo della cartilagine (cosiddetti condrometabolici), il cui effetto può essere sia
quello di inibire i processi degradativi della cartilagine sia quello di stimolare la sintesi di nuova matrice da parte del condrocita. I numerosi presupposti sperimentali, desunti da modelli in
vitro e nell’artrosi indotta nell’animale, indicano l’esistenza di valide premesse per un razionale impiego clinico di queste sostanze. Esistono alcuni studi clinici finalizzati alla valutazione
della qualità di vita del paziente artrosico sottoposto a trattamento condrometabolico. Pur non essendo ancora stata raggiunta la certezza definitiva di un effetto ritardante l’evoluzione del
processo artrosico, questi farmaci hanno mostrato un soddisfacente effetto sintomatico, anche in associazione a FANS.
Le infiltrazioni intraarticolari rappresentano un presidio terapeutico da riservare ad ambiente specialistico. Vi si può ricorrere, purché saltuariamente, in caso di episodi flogistici acuti o
subacuti, con un preparato corticosteroideo ritardo. Se gli intervalli tra le infiltrazioni sono sufficientemente prolungati (due-tre volte l’anno) non vengono riportate ripercussioni negative
sull’equilibrio metabolico della cartilagine articolare. Il trattamento infiltrativo comprende anche l’utilizzo di sostanze come l’acido ialuronico: che è normalmente presente a livello articolare ed
è spesso degradato ed insufficiente nella fase più avanzate di malattia. L’infiltrazione svolge una azione sostitutiva lubrificate ed antinfiammatoria.
La terapia chirurgica dell’artrosi si avvale di interventi palliativi e di interventi di sostituzione protesica delle articolazioni con artrosi avanzata. Gli interventi palliativi (enervazioni,
tenotomie, osteotomie, resezioni, artrodesi) mirano, attraverso provvedimenti diversi, ad attenuare il dolore articolare riducendo, modificando o abolendo il carico sull’articolazione interessata. La
sostituzione totale o parziale dell’articolazione, mediante protesi artificiale, ha, in molti casi, radicalmente modificato la prognosi del paziente artrosico, specie in caso di localizzazione
invalidante a carico di un’articolazione portante (anca e ginocchio).
La FIBROMIALGIA o sindrome fibromialgica (SFM) è una forma generalizzata di reumatismo extra-articolare non
infiammatorio, ad eziologia incerta. Letteralmente indica il dolore nelle strutture fibrose connettivali (tendini-legamenti).
Può essere definita come una sindrome dolorosa cronica, caratterizzata da dolore muscolo-scheletrico diffuso, da astenia (stanchezza), spesso da disturbi del sonno e dalla presenza di punti elettivi
di dolorabilità chiamati “tender points”.
Sono assenti segni di alterazioni ematiche e radiografiche; non ci sono aspetti istopatologici (danni sui tessuti evidenziabili con esami al microscopio) caratteristici.
Questa condizione viene definita “sindrome” poiché lo stesso paziente può avere segni (ciò che il medico riscontra alla visita) e sintomi (ciò che il malato riferisce) tra loro diversi,
contemporaneamente presenti nello stesso paziente e non necessariamente muscolo-scheletrici.
Il paziente può cioè avvertire, oltre al dolore diffuso e alla stanchezza, una varietà di disturbi di accompagnamento che riguardano non solo l’apparato muscolo-scheletrico e avere, oltre alla
dolorabilità dei punti tender, anche altre obiettività rilevabili alla visita del medico. Il corteo di disturbi presenti, spesso portano il malato a consultare innumerevoli specialisti ed eseguire
varie e innumerevoli indagini di laboratorio e anche strumentali prima che la diagnosi venga formulata.
Originariamente sono state distinte due forme di SFM, una forma primaria e una forma secondaria, in base alla possibilità o meno di individuare, in altre malattie (reumatologiche e non
reumatologiche) un fattore causale.
Più recentemente si preferisce parlare di forme “concomitanti” indicando la presenza contemporanea, nei pazienti con fibromialgia, di altre malattie che potrebbero non avere rapporto causale con la
stessa.
Storicamente, condizioni simili a quella che oggi viene definita SFM sono conosciute da più di 150 anni. I sinonimi utilizzati per descriverla sono stati numerosi; tra i più noti quello di
“fibrosite” coniato nel 1904 da Sir William Gowers, che aveva erroneamente attribuito a questa condizione un’origine infiammatoria. Nel 1977 due ricercatori canadesi, Hugh Smythe e Harvey Moldofky,
hanno usato il termine “fibromialgia” (introdotto nel 1976 da Hench) per indicare gli aspetti caratteristici di questa malattia (dolore diffuso, presenza di ben definiti punti dolorosi, astenia e
anche disturbi del sonno). Nel 1992 lo stesso termine è stato incluso nella classificazione mondiale delle malattie elaborata dall’organizzazione Mondiale della Sanità.
E’ una malattia frequente? C’è differenza di genere?
La SMF è una patologia caratteristica dell’età media, in particolare delle due fasce di età 25-35 e 45-55 anni. Alcuni studi indicano una più alta prevalenza nel gruppo di età compreso tra i 59 e i
74 anni. L’alta prevalenza nei gruppi di età avanzati, potrebbe essere spiegata anche da un accumulo di casi in queste classi di età considerata la cronicità del disturbo. La fibromialgia può
peraltro colpire anche soggetti in età più giovane, compresi adolescenti e bambini. La prevalenza nel gruppo di età tra i 9 e i 15 anni è stimata del 1.2% con alcuni studi indicativi di prevalenza
maggiore (fino al 6.2%). La prevalenza della fibromialgia è nettamente più alta nel sesso femminile con un rapporto femmine-maschio di 9:1 e 20:1 in base agli studi considerati. Molto spesso le donne
affette da SFM sono accomunate da condizioni similari: sono stati descritti livelli di istruzione scolastica medio-bassi, conflittualità famigliari e lavori poco gratificanti.
La motivazione della maggiore prevalenza nel sesso femminile non è chiara.
Non ci sono studi che dimostrino relazione tra fibromialgia e lunghezza del ciclo mestruale, uso di contraccettivi orali e durata del loro uso; non è stata dimostrata relazione con l’età della
menopausa. Certamente gli estrogeni hanno un ruolo importante nella modulazione del dolore, come pure un ruolo importante lo ha la ridotta produzione del testosterone presente nel sesso
femminile.
Probabilmente la differenza tra i due sessi va ricercata in una interazione tra fattori genetici, biologici, psicologici e socio-culturali diversi nei due sessi.
Le donne hanno comunque più dolore cronico degli uomini. Ampi studi lo dimostrano. In parte questa differenza di genere è data dalla maggiore prevalenza di alcune sindromi dolorose nel sesso
femminile; la maggiore incidenza di alcune sindromi dolorose nel sesso femminile rimane tuttavia ancora non spiegata. Le donne hanno maggiore attenzione al sintomo dolore, maggior sensibilità,
riconoscono il dolore più precocemente, hanno un corredo ormonale diverso che ne influenza la recezione e la modulazione, presentano anche sperimentalmente una maggiore sensibilità al dolore; nella
donna è inoltre differente la modulazione del dolore legata al sistema oppioide per un minore rilascio di oppioidi endogeni con azione inibitrice sullo stimolo doloroso. Anche le differenze
anatomiche (vagina e utero come porta di entrata di agenti esterni che possono causare sensibilizzazione midollare dolorosa) possono giocare un ruolo nella maggior percezione del dolore. Appare
peraltro evidente come la sola biologia non può spiegare tutto il problema della differenza di genere. La SFM ha prevalenza maggiore anche nell’ambito degli stessi nuclei famigliari, sia per motivi
genetici che per motivi ambientali; inoltre si esprime maggiormente nelle situazioni dove è presente una minore capacità individuale di elaborare e gestire fattori stressanti sia personali che
ambientali (cosiddetti “stressors”).
Il dolore muscolare diffuso, che rappresenta la componente principale della sindrome fibromialgica, è un problema comune e fonte di importante disabilità nella popolazione generale. La sua prevalenza
è stimata tra il 4 e il 13%. La prevalenza della fibromialgia nella popolazione generale, è stimata tra lo 0,7-4,8% in funzione della popolazione e delle metodologie di studio utilizzate. In Italia,
un recente studio epidemiologico effettuato da Salaffi e altri, su un campione di 2155 persone, ha calcolato una prevalenza della SFM del 2.2%. La SFM rappresenta una delle cause maggiori di
richiesta di visita sia specialistica reumatologica, sia di visita negli ambulatori di medicina generale per motivi osteo-articolari.
La SFM non è una patologia presente solo nei cosiddetti paesi industrializzati. E’ stata descritta anche nei paesi in via di sviluppo.
Come si diagnostica? E’ una malattia reale?
La sua diagnosi è una diagnosi clinica, basata essenzialmente sulla tipologia dei sintomi che il paziente riferisce al medico, associata alla positività di almeno 11 dei 18 punti dolorosi specifici
della malattia.
Se tale sindrome sia veramente reale è stato un problema molto dibattuto. Molti la considerano ancora un non problema o un problema psicologico-psichiatrico.
La complessa presentazione clinica di questa sindrome è da sempre oggetto di dibattito e polemica all’interno del mondo medico e numerose sono le ricerche in materia di trattamento farmacologico e
non farmacologico. La sindrome fibromialgica, dato confermato anche da recenti indagini su un campione di medici, è una affezione che gode di poco prestigio nella “gerarchia delle malattie”. La
ragione di questa scarsa considerazione deriva dalla sua cronicità, dalla localizzazione diffusa dei sintomi, dall’ assenza di alterazioni cliniche oggettivabili, dal fatto di non mettere in pericolo
di vita i soggetti che ne sono colpiti e dall’incertezza circa l’eziopatogenesi e le migliori modalità terapeutiche.
Negli ultimi dieci anni, tuttavia, essa è stata meglio definita attraverso studi che hanno stabilito le linee guida per la diagnosi. Questi studi hanno dimostrato che certi sintomi, come il dolore
muscolo-scheletrico diffuso e la presenza di specifiche aree dolorose alla digitopressione (tender points) sono presenti maggiormente nei pazienti affetti da sindrome fibromialgica rispetto alle
persone sane o ai pazienti affetti da altre affezioni reumatiche. Le ricerche mediche hanno inoltre dimostrato la presenza, nei pazienti con SFM, di una componente “genetica" predisponente e di
anomalie dei sistemi di recezione e trasmissione del dolore a livello del sistema nervoso centrale. Il modello quindi - fattori individuali predisponenti genetici- influenze ambientali – sviluppo di
malattia - può essere, al pari di altre malattie reumatiche, applicato anche alla sindrome fibromialgica.
La SFM rappresenta in sostanza un problema reale, che si lega a peggioramento della qualità di vita di chi ne è affetto, spesso ad alterazione dei rapporti famigliari, a costi importanti per esami,
visite, ricerca di terapie. Il dolore che il paziente riferisce è maggiore di quello riferito dai pazienti con artrite reumatoide o con osteoartrosi, quindi questa malattia si configura molto
impattante dal lato sociale.
Quali i segni e i sintomi?
Il dolore è il sintomo predominante della fibromialgia. E’ un dolore spesso totale, anche se talora può essere riferito in zone localizzate (collo, colonna dorsale, colonna lombare, torace, arti) per
poi diffondersi in altre sedi e diventare diffuso a tutto il corpo, a destra e a sinistra, sopra e sotto la cinta, alla colonna . E’ un dolore bruciante, lancinante, a fitte, come qualcosa che morde,
che disturba; è descritto con gli aggettivi più catastrofici e particolari. Nei pazienti con SFM è presente rigidità (specie mattutina, inferiore all’ora), con impressione soggettiva di gonfiore
delle zone dolorose e di parestesie (sensazione di formicolio, di spilli o aghi). Il dolore può essere favorito da qualsiasi oggetto che stringa, che schiacci, che avvolga, come calze, maglie,
vestiti, gioielli. Il paziente descrive spesso tensione e fascicolazione ai muscoli, sensazione di gambe senza riposo, specie durante il riposo notturno. Il dolore può essere avvertito anche al
torace, come “fitte al cuore” di intensità tali da togliere il respiro; può essere favorito da posizioni particolari, da movimenti ripetitivi e posture obbligate (tipo di lavoro). Il paziente può
descrivere artralgie alle mani e ad altre articolazioni con sensazione di limitazione della funzione, caratteristiche spesso confondenti e che potrebbero orientare erroneamente verso forme di
reumatismi infiammatori. Una accurata anamnesi e una precisa attenzione alla tipologia dei sintomi riferiti orientano peraltro in maniera corretta la diagnosi. Il dolore può variare di intensità
nell’ambito dei diversi momenti della giornata, può essere favorito dai cambiamenti metereologici, dal freddo, dall’umidità; può essere avvertito maggiormente in relazione a situazioni stressanti, a
stati di tensione, a momenti particolari della vita, a sovraccarichi di lavoro, a stress psichici; anche il periodo premestruale può peggiorarlo. In alcuni pazienti può assumere le caratteristiche
della iperalgesia (presenza di dolore eccessivo per lo stimolo che lo ha generato) e della allodinia (presenza di dolore per stimoli che in genere non provocano dolore). Difficilmente il paziente ha
periodi senza dolore anche se possono esserci periodi di maggior benessere. Il dolore si accompagna alla positività dei punti dolorosi o tender points. La mappa dei punti dolorosi è stata individuata
con chiarezza.
Altro sintomo fondamentale, quasi sempre presente, è la stanchezza che può essere totale, talmente invalidante da costringere il paziente a letto per lunghi periodi della giornata. La sindrome da
stanchezza cronica ne è l’estremo.
L’astenia cronica, accompagnata da una sensazione di muscoli dolenti (“knotted muscles”), è segnalata da più di nove pazienti su dieci; è predominante al mattino, peggiora nel pomeriggio e non trova
miglioramento dopo un adeguato periodo di riposo. Spesso lavori anche non eccessivi o una attività fisica moderata favoriscono la stanchezza, motivo per il quale il paziente fibromialgico tende a non
muoversi e ad abbandonare l’attività motoria.
Come già accennato possono essere presenti altri segni e sintomi.La cefalea muscolo-tensiva e anche l’emicrania sono frequenti; è comune la presenza di disturbi del sonno con sonno agitato, non
ristoratore e risveglio notturno frequente e precoce. I disturbi del sonno sono segnalati in oltre il 90% ei casi. Talora possono essere presenti apnee del sonno. Sono comuni i sintomi legati al
colon irritabile con dolori addominali e alternanza di stitichezza e diarrea, i disturbi dell’apparato genito-urinario come dolori pelvici, spasmi vescicali con minzioni frequenti, cistalgie
cosidette “ad urina chiara” (non infettive), tensione genitale con fastidio al solo toccamento, dismennorea. Spesso i pazienti riferiscono vertigini e disfunzioni oto-vestibolari, distonia e dolore
temporo-mandibolare, disturbi vasomotori periferici (come il fenomeno di Raynaud), ipersensibilità a luci, a suoni (fenomeni di sovraccarico funzionale), ansia, depressione, disturbi della memoria di
fissazione, difficoltà di concentrazione e difetto nella velocità di elaborare le informazioni (“foggy brain”, “fibro-fog”).
E’ ovvia quindi la preoccupazione del paziente e dei famigliari di fronte a tale insieme di sintomi con la successiva richiesta di continui esami di laboratorio e strumentali, spesso ripetuti, fonte
di errori diagnostici e di terapie inutili.
Il tutto è aggravato dallo scetticismo di molti medici verso l’effettiva presenza di questa sindrome (una malattia che non c’è) con giudizi sommari di tipo “psichiatrico”, “nevrotico” nei confronti
di questi pazienti e conseguente frustrazione e sensazione di nullità generata negli stessi.
Esistono dei criteri diagnostici?
Esistono precisi criteri diagnostici per la fibromialgia fissati dall’ American College of Rheumatology (ACR) nel 1990.
Tali criteri si basano sulla presenza di dolore diffuso da almeno tre mesi definito come un dolore presente da entrambi i lati del corpo ( a destra e a sinistra) , sopra e sotto la cinta associato a
dolore di colonna (cervicale, parete toracica anteriore, colonna dorsale e lombare) e dalla presenza di dolorabilità in 11 dei 18 punti dolorosi (tender) definiti. Un dolore alla spalla o al gluteo
corrispondono un dolore ad un lato del corpo. La lombalgia è considerata come un dolore nel segmento inferiore.
La positività di un punto tender è considerata tale se una palpazione eseguita con una forza di circa 4 kg/cm2 risveglia dolore (è la forza che sbianca l’unghia premendo sul punto doloroso) sul punto
stesso. La diagnosi di SFM viene posta in presenza di entrambi i criteri. La coesistenza di un altro disturbo clinico non esclude la diagnosi di fibromialgia.
Il metodo proposto dalla ACR ha una sensibilità dell’ 88.4% e una specificità dell’81%.
E’ importante ricordare che i tender points sono presenti, in un numero variabile da uno a quattro, anche nella maggior parte delle persone sane. Appare pertanto giustificato ritenere che i sintomi e
i segni della SFM si presentino nella popolazione come un continuum, la cui parte finale è rappresentata dai criteri ACR.
Peraltro nel fibromialgico molti altri muscoli o aree di inserzione di tendini e legamenti possono essere dolenti. I tender points possono essere talora dolenti alla sola lieve digitopressione o al
solo sfioramento.
MAPPA DEI TENDER
OCCIPITE (bilaterale, all’inserzione del muscolo sott’occipitale)
TRAPEZIO (bilaterale, al punto mediano del margine superiore del muscolo trapezio)
SECONDA COSTA (bilaterale, alla seconda sincondrosi costocondrale, appena a lato delle giunzioni sulla superficie superiore delle coste)
GRANDE TROCANTERE (bilaterale, posteriormente alla prominenza trocanterica)
GINOCCHIO (bilaterale, in corrispondenza del cuscinetto adiposo mediale del ginocchio, in sede prossimale rispetto alla linea articolare)
CERVICALE (bilaterale, superficie anteriore dei legamenti intertrasversari C5-C7)
SOVRASPINATO (bilaterale, all’origine del muscolo sovraspinato, al di sopra della spina scapolare, in prossimità del margine mediale della scapola)
EPICONDILO LATERALE (bilaterale, punto situato 2 cm al di sotto dell’epicondilo laterale)
GLUTEO (bilaterale, punto situato su quadrante supero-esterno della natica, nella plica anteriore del grande gluteo).


La diagnosi di fibromialgia è quindi una diagnosi clinica, che si basa cioè su quello che dice il paziente e sulla obiettività (i punti
tenders) riscontrata alla visita clinica. Non è una diagnosi che si fa con gli esami di laboratorio o con gli esami strumentali.
Tali criteri permettono sempre una diagnosi precisa?
I criteri ACR non sono sempre di facile impiego per porre la diagnosi di SFM. Non è infrequente trovarsi di fronte a pazienti che, pure presentando molti aspetti tipici della malattia, hanno meno
degli 11 tender points oppure lamentano un dolore non diffuso. L’utilizzo di detti criteri, utile in ambito di ricerca e di studio, può portare a sovrastimare o sottostimare la presenza di SFM. Tali
criteri sono comunque stati accettati come punto di partenza diagnostico e altri sintomi (tra cui l’astenia, la rigidità e i disturbi del sonno) sono stati aggiunti alla definizione originaria
((Dichiarazione di Copenaghen 1992). Si può quindi parlare di “possibile” SFM anche in persone che, pur presentando molti sintomi di questa complessa sindrome, hanno ad esempio meno degli 11 tender
points.
Da cosa va differenziata la SFM?
La diagnosi differenziale va posta nei confronti di affezioni reumatologiche e non reumatologiche che possono presentarsi con gli stessi sintomi. La diagnosi differenziale consente di precisare se la
SFM è primaria, secondaria oconcomitante. Deve essere posta, in particolare, nei confronti delle seguenti patologie:
• Muscolo-scheletriche (sindromi dolorose regionali, reumatismo miofasciale, sindrome da iperlassità legamentosa, altre
malattie reumatologiche autoimmuni come il LES, l’artrite reumatoide, la polimiosite, la sindrome di Sjogren,
l’osteomalacia)
• Endocrino-metaboliche (ipotiroidismo-iperparatiroidismo)
• Neurologiche (radicolopatie, nevralgie, neuropatie dolorose)
• Neoplastiche
• Infettive (Virus C, Borelliosi di Lyme legata a una Borellia trasmessa dalla puntura di una zecca)
• Psichiatriche
La SFM non è peraltro una diagnosi di sola esclusione, una diagnosi cioè che si fa escludendo solo la presenza di altre malattie. Certo è che i sintomi riferiti dal paziente possono trarre in inganno
orientando verso altre diagnosi o facendo diagnosticare come fibromialgici pazienti affetti da altre affezioni anche più gravi. E’ comune vedere eseguite moltissime indagini anche invasive, spesso
ripetitive, prima che si giunga a un inquadramento diagnostico preciso. È quindi molto importante che il medico di medicina generale sappia, nel sospetto, indirizzare il paziente verso lo specialista
reumatologo, medico che si farà poi carico di una diagnostica più orientata e della gestione del paziente. Una attenta anamnesi e un esame obiettivo accurato possono nella maggior parte dei casi
escludere anche altre condizioni cliniche di dolore cronico e di astenia.
Alcuni pazienti fibromialgici, come già detto, possono avere concomitanti altre malattie reumatiche. Una connettivite frequentemente associata è la sindrome di Sjogren, malattia che dà secchezza
dell’occhio e della bocca e che presenta alcuni sintomi spesso simili alla SFM. Alcuni pazienti con sola fibromialgia possono avere alcuni esami autoimmunitari, come gli anticorpi anti nucleo (ANA) e
il fattore reumatoide ( FR), positivi. In genere sono positività a basso titolo prive di reale significato in un contesto clinico che escluda malattie specifiche. La diagnosi di una malattia
reumatica è una diagnosi clinica che poggia cioè sulla storia, sui sintomi e segni clinici del paziente e non sul singolo dato di laboratorio. È comunque non infrequente che sia posto inizialmente il
sospetto di una forma reumatica infiammatoria. Il decorso clinico chiarirà peraltro poi la diagnosi precisa. Esistono, inoltre, dei segni e sintomi di sospetto capaci di orientare il medico verso una
diagnostica differenziale corretta.
Una volta confermata la diagnosi di fibromialgia, va proseguito il controllo clinico e il programma terapeutico evitando la trasformazione personale di ogni sintomo verso la presunta presenza di una
malattia grave. A questo riguardo vorrei dire come una visione eccessivamente “tecnicista” ( molto “contemporanea” ) della medicina, dove tutto deve essere relazionato a qualcosa di dimostrabile con
“una macchina” o comunque con uno strumento analitico per essere presente e reale, visione presente spesso anche negli stessi malati, non facilita un approccio sereno ad una malattia che “non c’è” se
guardiamo il dato strumentale. Il concetto che uno ha qualcosa se è dimostrato con gli esami va superato. In particolare il dolore cronico reumatologico non è legato a meccanismi quantificabili con
un dato biologico o analitico. Anche la definizione di gravità (in tutti noi presente), come qualcosa che può fare morire (la paura della morte è insita nell’animo umano) facilita nei medici e anche
nelle persone vicine al paziente, l’atteggiamento di disconoscimento della sindrome fibromialgica come problema serio e reale; probabilmente anche lo stesso paziente spesso inconsciamente vive questo
problema ed è alla spasmodica ricerca di qualcosa di strumentale che documenti la malattia. Nasce da questo non riconoscere la malattia come problema “reale” in quanto non dimostrato con ”qualcosa di
tecnicistico” l’atteggiamento di compatire più che capire il paziente.
Il problema della stanchezza e i disturbi del sonno.
Circa il 90% dei pazienti affetti da sindrome fibromialgica riferisce affaticamento. Tale affaticamento può essere così severo e limitante da portare il paziente ad abbandonare ogni attività fisica e
di svago e passare gran parte della giornata a letto. La fatica può essere destruente. Il paziente fibromialgico ha la sensazione che qualsiasi attività fisica lo affatichi e lo peggiori; la sua
resistenza alla fatica è molto ridotta; alcuni capiscono che una attività fisica regolare migliora i sintomi, ma avvertendo spossatezza dopo l’attività fisica anche non massimale tendono ad
abbandonarla. La stanchezza, in alcuni pazienti, può essere il sintomo preminente, più limitante del dolore diffuso. Tali pazienti possono essere diagnosticati come affetti da sindrome da
affaticamento cronico (CFS). I confini tra sindrome fibromialgica e sindrome da affaticamento cronico sono labili, trattandosi verosimilmente dello stesso problema con i sintomi preminenti (astenia-
dolore), che fanno propendere per una diagnosi rispetto a un'altra. Spesso può risultare difficile distinguere le due condizioni o può essere fatta diagnosi differente in momenti differenti.
La maggior parte dei pazienti affetti da sindrome fibromialgica riferisce inoltre disturbi del sonno con sonno non ristoratore. Il paziente può non trovare difficoltà ad addormentarsi, ma ha un
risveglio precoce con difficoltà poi al riaddormentamento. E’ un po’ quello che succede anche a soggetti non fibromialgici in situazione di stress prolungati. Il risveglio precoce e la conseguente
stanchezza mattutina sono campanelli di allarme di queste condizioni. Talora il paziente ha invece continui risvegli con sonno molto leggero. Pare assente nel fibromialgico la fase REM del sonno
ristoratore. L’assenza della fase profonda del sonno può alternare importanti funzioni del corpo e alterare la percezione del dolore. È molto interessante, a questo proposito, il nesso tra la
sindrome fibromialgia e la sindrome delle apnee notturne spesso presenti nello stesso paziente. Tale sindrome porta il paziente ad avere sonno rumoroso (russante) con periodi di apnee (mancanza di
respiro ) anche prolungate con ripresa poi di respiro; il paziente ha poi problemi di addormentamento incoercibile durante il giorno. E’ dimostrato in questi pazienti un maggior rischio
cardiovascolare (aritmie o altri disturbi) oltre che un maggior rischio di incidenti traumatici (automobilistici o di altro tipo); è quindi presente una maggiore mortalità. In entrambi le sindromi il
paziente al risveglio si sente molto affaticato, come se non avesse dormito.
Ci sono fattori di rischio per lo sviluppo della SFM?
E’una malattia presente solo nei depressi?
Il fattore di rischio principale per avere una sindrome fibromialgica è sicuramente il sesso femminile. I dati di prevalenza e di incidenza di questa sindrome, nettamente maggiore come già detto nel
sesso femminile, ne sono la conferma; la motivazione peraltro non è chiara. Non sono stati ancora definiti precisi fattori genetici predisponenti; alcuni dati orientano in tal senso compresa la
possibile presenza di sindrome fibromialgica nei componenti della stessa famiglia; l’influenza dei fattori ambientali ha comunque un ruolo verosimilmente maggiore.
Fattori socio-culturali sono importanti nel suo sviluppo; la fibromialgia mostra una relazione inversa con il livello di educazione, appare maggiormente associata a pazienti con problemi famigliari
come l’essere divorziato-a,
con l’ avere problemi fisici che incidano sulla personale autostima, con eventuali trascorsi di “abuso” psichico e sessuale specie in età adolescenziale e giovanile, con l’essere un immigrato o
disadattato, con il vivere in aree socialmente depresse, con il non avere motivazioni sociali adeguate, con l’avere un tipo di lavoro manuale non gratificante. Anche la personalità del singolo è
predisponente specie se condiziona una visione passiva degli eventi. Il ruolo dei fattori meccanici, delle posture scorrette, di fattori antropometrici personali, di fattori esterni meccanici come
movimenti ripetitivi, vibrazioni, sono stati valutati trovando spesso correlazione con il successivo sviluppo di dolore muscolo-scheletrico prima localizzato, poi diffuso e infine di SFM. Un trauma,
anche non grave come il colpo di frusta, può essere descritto come origine dei disturbi; le circostanze del trauma possono anch’esse avere un ruolo favorente. La lombalgia benigna cronica, attribuita
spesso a lavori particolari e poco apprezzati dal paziente, può essere un fattore favorente; in maniera simile anche dolori muscolo-scheletrici regionali, localizzati, persistenti o recidivanti
possono rappresentare il primo esordio di un dolore che poi diventa diffuso specie se si inserisce in una personalità particolare o in un contesto personale socio-culturale e ambientale favorente. Il
ruolo delle infezioni nello sviluppo della fibromialgia è stato molto studiato. Molti pazienti riferiscono l’esordio della malattia dopo infezioni virali, compresa l’infezione da virus C o la
Borelliosi Lyme. Solo una minoranza di pazienti peraltro riportano male di gola, ingrossamento dei linfonodi, febbricola prima dell’esordio. Interessante è il fatto che una infezione virale come
trigger di malattia è stata proposta anche nella sindrome da stanchezza cronica. La presenza di depressione è un fattore predittivo per lo sviluppo di dolore muscolo-scheletrico cronico e della
fibromialgia. Circa il 30% dei fibromialgici hanno problemi di depressione e questa comunque rappresenta un fattore di peggioramento. Anche l’ansia è comune. Molto spesso, peraltro, sia la
depressione che l’ansia sono reattive, secondarie, al dolore cronico, alla presenza di un dolore persistente in grado di peggiorare a volte anche drammaticamente la qualità di vita. Si crea così un
circolo vizioso tra dolore- depressione- ansia- maggior dolore-maggior ansia e depressione, molto impattante per il paziente. Il paziente sta male e ha la sensazione di non essere, ed il più delle
volte non lo è, compreso; un semplice sintomo di accompagnamento genera paure; il paziente vive la consapevolezza che è inutile spiegare, perché la percezione del proprio vissuto è negata dal mondo
esterno,
Anche i cambiamenti del tono dell’umore o del pensiero sono comuni nella SFM. I pazienti affetti da fibromialgia possono riportare difficoltà a concentrarsi oppure a eseguire semplici elaborazioni
mentali.
I valori di depressione e ansia registrati nei pazienti fibromialgici sono circa tre volte superiori rispetto alla popolazione generale. Tuttavia la SFM, benché possa essere ravvicinata alle sindromi
depressive e ansiose, ai problemi somatiformi e di conversione o alla sindrome di stress post traumatico, è una entità clinica ben distinta. La relazione temporale esistente tra la SFM e l’ansia e la
depressione rimane controversa. Tuttavia, come già detto, almeno una parte dei ricercatori è concorde nell’affermare che ansia e depressione sono una conseguenza piuttosto che una causa. E’ evidente
però che queste condizioni psichiatriche sono in grado di condizionare la variabilità della sintomatologia nei pazienti.
Si può dire, in sintesi, che le situazioni psicologiche-psichiatriche rappresentano un fattore di rischio per lo sviluppo della fibromialgia vista la loro reale presenza in un buon numero di pazienti
anche se in alcuni pazienti possono peraltro essere conseguenza della malattia.
Che lo stress psicologico abbia un’importanza causale in alcuni pazienti mentre in altri sia la conseguenza della malattia è comunque accertato.
La sindrome fibromialgica non è peraltro né un disturbo puramente psichiatrico, né un disturbo ipocondriaco dai quali va quindi differenziata.
Quali i meccanismi eziologici?
Abbiamo visto come molti e differenti possano essere i fattori predisponenti o scatenanti la sindrome fibromialgica e come sia difficile pensare che tale sindrome sia generata da una singola causa.
L’eziopatogenesi della SFM non è ancora stata chiarita.
Secondo una delle ipotesi maggiormente accreditate la SFM sembra derivare da una alterazione dei meccanismi di processazione e modulazione del dolore a livello del sistema nervoso centrale.
L’iperalgesia, il dolore riferito e l’allodinia, osservabili nei pazienti fibromialgici, sembrano essere l’espressione di questa alterazione nocicettiva.
Nei pazienti con SFM si instaura una forma di ipereccitabilità neuronale con modificazioni funzionali a carico dei neuroni del corno dorsale del midollo spinale deputati alla trasmissione del dolore.
Questi cambiamenti portano quindi non solo a una aumentata eccitabilità neuronale, ma anche a un ampliamento del campo nocicettivo, a una ridotta soglia del dolore e al reclutamento di vie afferenti
(fibre Aβ) la cui attivazione, normalmente, non provoca dolore. Nei fibromialgici è poi presente anche una sommazione temporale del dolore (o wind up). Si tratta di un fenomeno di amplificazione del
dolore legato alla sommazione ripetuta, ad intervalli precisi, di stimoli nocicettivi (dolorosi).
Nei pazienti fibromialgici c’è, in sostanza, la presenza di un dolore maggiore rispetto ai soggetti normali.
Il fenomeno del wind up fa parte del processo di sensibilizzazione centrale. Le cause di questa sensibilizzazione centrale non sono del tutto chiarite.
Sono state identificate diverse alterazioni metaboliche, istochimiche, vascolari, morfologiche e funzionali a carico del tessuto muscolare dei pazienti fibromialgici. Il loro ruolo non è stato però
del tutto chiarito. Queste alterazioni potrebbero semplicemente riflettere il decondizionamento fisico osservabile in molti di questi pazienti. Anche la ipermobilità articolare generalizzata, come
fonte continua di microtraumi e quindi di possibile induzione di SFM è stata proposta, ma l’esatta relazione che intercorre tra queste due condizioni non è stata chiarita.
A livello centrale è stata descritta una riduzione della vascolarizzazione di varie aree (talamo e nucleo caudato in particolare) implicate nella regolazione del dolore.
Alcuni studi hanno evidenziato la presenza di alterazioni nei meccanismi discendenti del controllo del dolore.
Sono stati osservati ridotti livelli di serotonina (sostanza che regola anche il sonno e l’umore) e noradrenalina; il sistema degli oppioidi non pare invece coinvolto. Nel liquido cerebro spinale
sono stati riscontrati elevati livelli di sostanza P.
Dal punto di vista ormonale sono stati documentati aumentati livelli di ormone adrenocorticotropo, di ormone follicolo stimolante e diminuiti livelli del fattore di crescita insulino-simile-1, di
ormone della crescita, di estrogeni e di cortisolo urinario.
E’ stata supposta, data la stretta relazione tra SFM e stress, un’alterazione a carico dell’asse ipotalamo-ipofisi-surrene, sistema coinvolto nei meccanismi di risposta allo stress e a sua volta
collegato al sistema nervoso simpatico e agli altri assi ormonali.
L’alta incidenza della SFM all’interno dei gruppi famigliari ha fatto orientare la ricerca verso il ruolo dei fattori genetici e in particolare ha evidenziato il ruolo dei polimorfismi genici nei
sistemi serotoninergico, dopaminergico e catecolaminergico.
Le condizioni ambientali, i fattori esterni già menzionati (virus, traumi fisici o psichici) devono essere interpretate come condizioni in grado di attivare e condizionare lo sviluppo della
SFM.
I tratti psicologici che accomunano questi pazienti hanno portato a parlare di personalità fibrositica e di pain prone personalità (atteggiamento perfezionistico, esagerato impegno lavorativo,
controllo eccessivo di rabbia e ostilità, aumentata valutazione soggettiva del dolore, incapacità a rilassarsi). Questi tratti agiscono nell’influenzare l’andamento della SFM; non sono fattori
causali certi.
In sintesi la SFM è una patologia multifattoriale in cui interagiscono più variabili (biologiche, psicologiche, sociali) e la cui origine (centrale o periferica) non è stata del tutto chiarita. Molto
verosimilmente il processo, una volta scatenato, viene alimentato sia da cause centrali che da fattori periferici.
Il modello bio-psico-sociale è certamente quindi più rispondente alla realtà. Tale modello cerca di vedere la malattia attraverso la co-presenza di vari fattori che associati, con maggiore o minore
forza nel singolo individuo, possono spiegare la persistenza del dolore cronico diffuso e della SFM. Sono fattori biologici (alterazioni di mediatori chimici quali i neurotrasmettitori a livello
centrale, particolare vulnerabilità dei muscoli a microtraumi ripetuti e altri), fattori psicologici (personale comportamento di fronte al dolore, capacità di autonomia, capacità di affrontare il
dolore, tipo di personalità, personale autostima, senso di abbandono e di mancanza di aiuto), fattori e variabili socio-culturali (stato civile, problemi coniugali, problemi genitoriali, grado di
cultura, disadattamento sociale, esperienze passate di dolore sia personali che vissuti familiari, dinamiche familiari particolari, stress da prestazione sia sportiva che sociale con carico
psicologico inadeguato sul singolo soggetto, abusi sessuali e fisici specie in età adolescenziale), che incidono sul singolo paziente nella espressione clinica di malattia. Molti di questi problemi
sono particolarmente importanti nell’ adolescente e spiegano l’esordio e la possibile persistenza della fibromialgia nelle classi di età più giovanile. Che ci sia poi nel paziente un’alterazione dei
meccanismi di trasmissione, modulazione e processazione degli stimoli periferici da parte del sistema nervoso centrale che portano e mantengono il dolore cronico è accertato. Questo significa in
sostanza che sono state dimostrate variabili genetiche e biologiche che fanno in modo che il paziente affetto da fibromialgia abbia più dolore a causa di una maggiore espressione a livello centrale
dello stimolo doloroso e della alterata possibilità di modularlo e controllarlo. Le variabili sociali, cognitive, comportamentali, culturali, razziali, sociali rivestono poi molta importanza nel
modulare la “spiacevole esperienza” personale del dolore e possono incidere nel processo che porta all’amplificazione del dolore e alla sua cronicizzazione. Stress, ansia, depressione, credenze e
significato attribuito culturalmente al dolore, strategie personali in risposta al dolore (atteggiamento attivo o passivo), grado di autostima, tono dell’umore, situazioni di paura-frustrazione sono
tutte situazioni importanti nella singola persona. Nei fibromialgici è alterato, “esaurito”, anche il sistema di reazione allo stress che rappresenta l’insieme delle reazioni messe in moto
dall’organismo per contrastare eventi esterni nocivi. Tale esaurimento, legato a una eccessiva stimolazione cronica, porta a una maggiore sensibilità al dolore. Si può avere dolore cronico se i
centri dolorosi centrali sono lesi anatomicamente nella loro funzione (come nel dolore cronico post ictus) ma anche se sono lesi solo funzionalmente.
SCHEMA RIASSUNTIVO DI INQUADRAMENTO DELLA SINDROME FIBROMIALGICA
|
FM secondaria 1. Endocrinopatie |
|
FM concomitante 1. Osteoartrosi |
|
SINDROME FIBROMIALGICA PRIMARIA |
1. artrite reumatoide |
|
|
|
|
|
|
Fattori socio-ambientali 1. Stress lavorativi-familiari |
CARATTERISTICHE |
Fattori neuroendocrini 1. Intolleranza al freddo |
|
Fattori bio-meccanici 1. Iperlassità |
|
Fattori psicologici 1. disordini della sfera affettiva |
Come si cura la fibromialgia?
Considerata la complessità del paziente fibromialgico con tutte le variabili bio-psico-sociali-comportamentali presenti e la scarsa conoscenza
sulle eventuali basi “biologiche” della malattia è ovvio che la terapia rimane empirica.
Qualsiasi approccio terapeutico non può peraltro prescindere da una visione di insieme del paziente.
La SFM è una patologia difficile da trattare perché la sua espressione clinica è variabile e il dolore cronico, che la caratterizza, rappresenta una esperienza complessa che determina conseguenze
invalidanti non solo sul piano fisico, ma anche su quello psicologico e sociale.
L’intervento terapeutico di un singolo operatore non può essere sufficiente a garantire una gestione ottimale del dolore cronico e degli altri sintomi. Un approccio interdisciplinare sembra
rappresentare la strategia terapeutica con migliori possibilità di successo.
Tale trattamento si propone di aiutare il paziente a controllare il proprio dolore e i problemi correlati, di aiutare il paziente a migliorare il proprio livello di funzionalità fisica, di ridurre lo
stress psicologico causato dalla malattia, di aiutare il paziente a un corretto uso dei farmaci sia antidolorifici che psicotropi, riducendo il livello di ansia, depressione e paura; si propone in
sostanza di migliorare la qualità di vita del paziente favorendo il ritorno alle proprie attività.
L’efficacia di tale tipo di intervento è supportata da una forte evidenza di efficacia. Si raccomanda, in particolare, di intervenire con l’educazione, la terapia cognitivo-comportamentale e
l’esercizio fisico.
L’approccio terapeutico deve quindi prevedere l’azione combinata del reumatologo, del fisiatra, dello psicologo clinico, del fisioterapista, del terapista del dolore (ove necessario), del terapista
occupazionale, del medico di medicina generale, dell’infermiere, della famiglia del paziente.
La figura centrale del programma ovviamente è il paziente che deve essere coinvolto attivamente e che deve diventare un membro del team collaborando con gli altri operatori.
L’approccio multidisciplinare intende guidare i pazienti, attraverso un corretto trattamento farmacologico e l’insegnamento di opportune strategie, alla capacità e responsabilità di gestire i sintomi
e le conseguenze della malattia, con l’obiettivo di migliorare la qualità di vita controllando il dolore, migliorando le attività funzionali quotidiane, rendendo discontinuo l’utilizzo dei servizi
sanitari, migliorando la disabilità. La possibilità di conseguire risultati positivi è legata in particolare al grado di self-efficacy (autoefficacia) del paziente. Il paziente deve appropriarsi o
migliorare la capacità-abilità di riuscire a raggiungere un determinato obiettivo terapeutico prefissato.
Un approccio secondo il classico modello di causa-effetto non si adatta alla complessità della SFM. L’eziologia e il danno fisico non sono i determinanti fondamentali della riduzione della qualità di
vita e della disabilità del paziente fibromialgico. Gli aspetti psicosociali sono decisamente più significativi di quelli biologici.
Il paziente deve capire la malattia, deve capire che è una malattia non evolutiva nel senso anatomico-deformante di danno strutturale, deve capire che molte variabili personali sono importanti, deve
capire che c’è una reale alterata soglia del dolore, deve capire che l’atteggiamento attivo verso la malattia è importante, deve capire che la visione “strumentale” alla disperata ricerca di qualcosa
che sia identificato dagli esami è distorta, deve capire che deve avere una guida terapeutica e che il solo farmaco non può risolvere tutto.
Quali i farmaci?
La prescrizione della terapia farmacologica rappresenta una parte essenziale dell’intervento terapeutico multidisciplinare. Tuttavia tale terapia, se considerata come unico
approccio, porta benefici limitati.
Le opzioni terapeutiche farmacologiche mirano essenzialmente al controllo del dolore attraverso farmaci analgesici sia periferici (analgesici minori, anti infiammatori classici), che centrali (come
il tramadolo).
I farmaci analgesici periferici (paracetamolo) possono dare beneficio, se pure limitato. I farmaci anti infiammatori, molto usati nella terapia dei reumatismi infiammatori, hanno scarsa efficacia
nella SFM. Il tramadolo, un farmaco ad azione centrale, in parte agonista oppioide, in parte con azione sulla ricaptazione della serotonina e della noradrenalina, può avere beneficio. Gli oppioidi
classici hanno meno efficacia nella fibromialgia, rispetto al loro uso in altre patologie caratterizzate da dolore cronico: sono inoltre gravati da effetti collaterali fastidiosi come nausea,
sedazione, stipsi, che ne limitano l’uso in questi pazienti.
I cortisonici sono inefficaci.
Un ruolo importante hanno i farmaci in grado di facilitare il sonno, miorilassare e controllare il dolore attraverso una sua modulazione centrale. Questi farmaci comprendono
gli antidepressivi triciclici (amitriptilina), i farmaci ad azione prevalente miorilassante (ciclobenzaprina), gli inibitori della ricaptazione della serotonina (paroxetina, fluoxetina, sertralina),
i nuovi farmaci inibitori della ricaptazione della serotonina e della noradrenalina (duloxetina, venlafaxina, milnacipran). Tali farmaci non sono privi di effetti collaterali (sonnolenza, stipsi,
bocca asciutta, vertigini); vanno introdotti lentamente, il miglioramento che portano è graduale, diverso nei singoli pazienti.
Gli ipnotici sono utili per migliorare il sonno. Non c’è evidenzia di efficacia delle benzodiazepine (ansiolitici), della melatonina, degli
anabolizzanti e degli integratori, degli anti ossidanti.
Appaiono invece efficaci alcuni farmaci anti epilettici come il pregabalin, unico farmaco approvato per il trattamento della SFM da parte dell’US Food and Drug Administration negli USA. Il loro
effetto analgesico non è del tutto chiarito, ma hanno dimostrazione di limitare l’eccitabilità neuronale e di incrementarne l’inibizione.
Il supporto psicologico
Il supporto psicologico e la terapia cognitivo- comportamentale sono, come già detto, molto importanti.
Va ribadita l’importanza dell’intervento educativo per migliorare la self-efficacy del paziente, favorire l’aderenza ai programmi terapeutici, distogliere l’attenzione dai
sintomi orientandola verso il miglioramento della capacità funzionale e della qualità di vita. Il paziente deve, attraverso il supporto anche psicologico e le terapie comportamentali, diventare
responsabile delle proprie scelte in materia di gestione della malattia (self management). Appare fondamentale impostare una corretta relazione paziente-terapeuta. E’ utile che gli incontri educativi
vengano organizzati e svolti in piccoli gruppi, perché la possibilità di condividere le proprie esperienze con altre persone affette dalla medesima patologia può essere un importante strumento
terapeutico.
La terapia cognitivo-comportamentale è in grado di insegnare al paziente tecniche e strategie per la gestione degli aspetti emotivi legati a eventi stressanti.
E’ molto importante motivare il paziente all’attività fisica graduale e costante, facendo riferimento al decondizionamento fisico e alla perdita delle capacità funzionali legate alla malattia.
Anche le tecniche psicofisiche di rilassamento (training autogeno e altre) permettono il controllo del dolore modificando l’ansia o il comportamento presente in relazione alla sintomatologia
(coping).
L’ importanza dell’ esercizio fisico
L’esercizio fisico è in grado di apportare benefici sia sul piano fisico che psicologico. Agisce attraverso il miglioramento del trofismo muscolare, migliorando la
capillarizzazione e riducendo l’ipossia muscolare. Favorisce inoltre la secrezione di endorfine e dell’ormone della crescita; aumenta la produzione di serotonina a livello cerebrale e attiva i
meccanismi adrenergici di inibizione del dolore. L’inattività nei pazienti fibromialgici è molto dannosa sia sul piano fisico (riduzione forza muscolare, decondizionamento, maggiore rigidità), sia
sul piano psicologico (paura del movimento, depressione, perdita di fiducia in se stessi).
L’esercizio da eseguire è quello aerobico (corsa lenta, cyclette, cammino, nuoto), a intensità bassa-moderata, adattandolo alla situazione di partenza del paziente e poi incrementandolo lentamente.
L’esercizio fisico migliora anche il dolore e riduce i tender points. L’aumento del dolore e della stanchezza, possibili inizialmente, diminuiscono con il proseguo dello stesso e possono essere
evitati introducendo pause nella singola seduta.
Lo stretching è utile se abbinato al training aerobico.
Il talk test (capacità di parlare durante l’esercizio) è un metodo utile per controllare la giusta intensità dello stesso. Alla fine dell’esercizio il paziente deve sentirsi come “se avesse potuto
fare di più”.
L’acqua è un ottimo ambiente per gli esercizi. Permette al paziente di trovarsi in una situazione di scarico ponderale, permettendo in tal modo ad alcuni pazienti di eseguire esercizi che altrimenti
non sarebbero in grado di eseguire. La temperatura dell’acqua ottimale (tra 28° e 32°) può donare sollievo al dolore.
Che ruolo hanno le terapie complementari non farmacologiche?
Le cure termali, compresi i “bagni di fieno” possono avere benefici in singoli pazienti.
La validità delle varie terapie fisiche (TENS, ultrasuoni e altre) appare limitata. L’elettrostimolazione nervosa trans-cutanea (TENS) è la forma più comune di corrente analgesica. Trova
giustificazione se il dolore è localizzato.
Nella pratica clinica, l’utilizzo come unica modalità terapeutica, delle terapie fisiche non è raccomandato; può essere forma terapeutica coadiuvante in situazioni particolari.
Il massaggio, dal punto di vista terapeutico, sembra contribuire alla riparazione tessutale, alla modulazione del dolore, al rilassamento muscolare e al miglioramento dell’umore. Il suo meccanismo
d’azione non è chiaro: pare agisca mediante modificazioni a livello del sistema nervoso autonomo, attraverso il miglioramento della circolazione sanguigna e linfatica e attraverso l’attivazione del
Gate Control (“porta” di controllo del dolore) e del sistema serotoninergico. Esistono numerose tecniche di massaggio: il massaggio va adattato alla ridotta soglia del dolore di tali pazienti, con
tecniche specifiche. La sua reale utilità nella SFM non è del tutto dimostrata.
Le tecniche di biofeedback (il più utilizzato nella SFM è quello elettromiografico) possono dare discreto beneficio e possono essere tecniche coadiuvanti.
Controversi sono i dati sull’agopuntura anche se in singoli pazienti può essere un buon approccio.
Sono state sperimentate altre tecniche di rilassamento, di meditazione, di ipnosi, di auto-sostegno, di biofeedback. I risultati non sono comunque convincenti specie se queste tecniche sono usate
come unica terapia.
In sintesi i punti focali della strategia terapeutica sono quindi:
• la diagnosi corretta
• la valutazione della malattia (presenza di forte dolore, associazione di disturbi psichiatrici, depressione come conseguenza del dolore o concomitante,somatizzazione)
• l’educazione (la comunicazione) sul perché della malattia cercando di enfatizzare i fattori scatenanti, la descrizione delle caratteristiche della malattia, la buona prognosi, l’importanza di
stili di vita corretti, dell’attività fisica regolare, dell’intervento
inter-multidisciplinare; l’educazione va rivolta anche ai famigliari del paziente
• l’impostazione di una attività fisica aerobica regolare submassimale
Si potrà successivamente intervenire con farmaci, in primo con basse dosi di triciclici o con farmaci cosiddetti SSRI (inibitori del reuptake della serotonina ) o SNRI (inibitori della ricaptazione
di serotonina e noradrenalina) o con anti epilettici (pregabalin) associati o meno ad analgesici puri (paracetamolo-tramadolo).
Sarà importante il sopporto psicologico e psichiatrico, ove necessario, come pure la terapia fisiatrica- riabilitativa.
Un programma terapeutico interdisciplinare basato sull’ educazione del paziente, sulle tecniche psicoterapeutiche, sulla programmazione di un esercizio fisico regolare non massimale, sull’uso di
farmaci e di altre tecniche di provata efficacia appare quindi fondamentale.
Punti da ricordare
• La fibromialgia è una malattia caratterizzata da dolore cronico diffuso associato alla presenza di punti dolorosi (tender points), da stanchezza, disturbi del sonno e da altri sintomi di
accompagnamento.
• Non è una malattia infiammatoria che porta danni agli organi interni o alle strutture osteo-articolari
• Può peggiorare la qualità di vita
• I meccanismi ezio-patogenetici non sono del tutto chiariti
• La terapia è multidisciplinare